Oncology
From imaging to clinical diagnosis
Publié le 02 Jan 2019Lecture 10 min
Femmes à risque de cancer du sein - Surveillance et prise en charge
B. BARREAU*, C. PAILLET-PONTIER*, V. BOUTE**, J. CHOPIER*** *Centre Futura, Axular Radiologie, Anglet **Centre François Baclesse, Caen ***Service d’imagerie médicale, Hôpital Tenon, Paris
Le dépistage des femmes à risque pose deux problématiques : celle de l’estimation du risque et celle de la surveillance en fonction de ce risque estimé. Les modalités de cette surveillance doivent être expliquées aux femmes, afin qu’elles appréhendent les avantages d’un diagnostic précoce mais aussi ses contraintes et ses limites (examens complémentaires, faux positifs). Il est nécessaire de les éduquer à gérer leur dossier afin de disposer de toutes les informations nécessaires et de les inciter à consulter si elles remarquent une modification clinique. Dans le cadre des femmes ayant un risque génétique, nous limitons notre sujet à la surveillance mammaire.
Le fondamental : une surveillance clinique appropriée
L’examen clinique à la recherche d’une éventuelle symptomatologie a une place fondamentale dans la surveillance mammaire. Rigoureux, il inclut une inspection statique et dynamique, la palpation des seins, des aires ganglionnaires axillaires, sus-claviculaires et de la paroi thoracique. Les constatations cliniques sont mentionnées clairement pour comparaison.
Les moyens de surveillance en imagerie
Surveillance des femmes à risque génétique
• Surveillance des femmes à haut risque
Avant de proposer toute surveillance, le haut risque génétique doit être évalué. Il existe de multiples modèles de calcul du risque. Le plus approprié est de proposer à la patiente une consultation d’oncogénétique, afin d’évaluer au mieux ce risque. En fonction des résultats et du souhait de la patiente, la recherche d’une mutation constitutionnelle délétère sera recherchée. L’intérêt d’une telle consultation se justifie en fonction des antécédents familiaux ; un calcul simplifié est proposé par Eisenger – Expertise collective INSERM-FNCLCC(1) (tableau).
L’examen clinique est semestriel et débute dès l’âge de 20 ans pour les femmes porteuses d’une mutation BRCA1 ou BRCA2. Les tumeurs BRCA1 sont peu différenciées et proliférantes, les cancers de l’intervalle sont plus fréquents. La surveillance en imagerie est une option, l’alternative étant la mastectomie prophylactique(2). Malgré son caractère mutilant, elle est la mesure la plus efficace de prévention du risque de cancer du sein chez une femme porteuse d’une mutation BRCA1/2. C’est un choix personnel qui est envisagé après discussion avec le chirurgien, l’oncogénéticien et une consultation avec un psychologue est proposée.
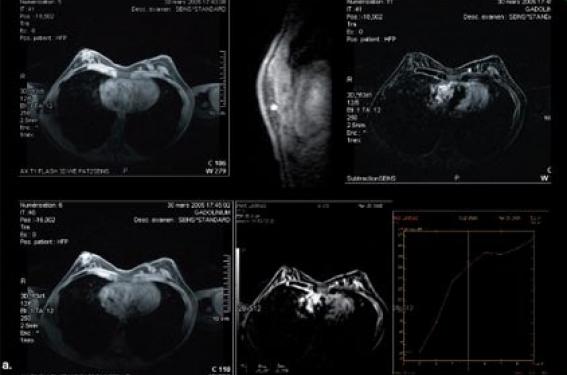
En dépistage, une IRM mammaire annuelle avec des séquences dynamiques (injection de produit de contraste) est proposée. Elle est toujours suivie d’une mammographie et d’une échographie. Cet examen permet de rechercher des cibles accessibles à une biopsie s’il existe un rehaussement individualisé à l’IRM (figure 1).
Figure 1 : Antécédent personnel de traitement conservateur du sein gauche (CCI, grade 3), patiente mutée BRCA1. a : IRM mammaire : masse du sein gauche (ACR5). Mammographie image non vue (anomalie très interne). b : Échographie mammaire (microbiopsie échoguidée), a. histologie : CCI.
En France, ces recommandations s’appliquent aux femmes ayant un haut risque génétique (> 30 %). En Europe (EUSOBI) et aux États-Unis (American Cancer Society - ACS), cet examen est prescrit pour des risques ≥ 20- 25 %(3). Ils sont définis par l’ACS : femmes porteuses d’une mutation BRCA1 ou BRCA2, patientes non mutées apparentées au 1er degré avec une mutation BRCA, femmes dont le risque cumulé au cours de la vie est ≥ 20-25 % tel que défini par les modèles tenant compte des facteurs de risque familiaux(3). Il est recommandé de commencer le dépistage en imagerie à 30 ans(2). Les cas justifiant un suivi radiologique plus précoce sont discutés au cas par cas. Plus jeune, la prévalence du cancer du sein et la valeur prédictive sont faibles et doivent être mises en balance avec la toxicité des rayons X dans cette population de femmes qui seraient plus radiosensibles. Nonobstant, la mammographie doit être réalisée pour les patientes à haut risque afin de rechercher d’éventuelles calcifications qui pourraient être le témoin d’un carcinome canalaire in situ (CCIS). La mammographie est numérique de manière préférentielle pour les femmes de moins de 50 ans(4). Cette surveillance est sans limitation de durée.
Avant tout début de surveillance, la patiente doit être informée de l’excellente sensibilité du dépistage proposé mais de la moindre spécificité, notamment de l’IRM, ce qui pourra induire des « faux positifs » avec la réalisation d’investigations complémentaires comme les biopsies guidées par l’imagerie.
De par les types histologiques (la plus grande fréquence des carcinomes médullaires pour les patientes porteuses d’une mutation BRCA1), les masses de contours réguliers bénéficient d’une microbiopsie car certaines lésions peuvent se traduire par des formes rondes avec des contours réguliers, évoquant un adénofibrome, voire une lésion kystique (figure 2).
Figure 2 : 32 ans : antécédents familiaux de cancer du sein : soeur mutée BRCA1. Nodule lisse, mobile du QSI du sein gauche. a : Mammographie, masse ronde de densité élevée avec des contours plutôt circonscrits. b : Échographie mammaire, image hypoéchogène, homogène de contours circonscrits avec un renforcement postérieur : ACR4a. c : Carcinome canalaire infiltrant, grade 2 RE-, RP+, HER2 -, N-.
• Surveillance des femmes à risque modéré
L’évaluation de ce risque est le plus difficile ; cependant, de cette estimation vont dépendre le type et le rythme de surveillance. La consultation d’oncogénétique peut être proposée selon les mêmes critères que précédemment. Généralement, la mammographie est annuelle (numérique pour les femmes de < 50 ans) associée à une échographie. Si le risque cumulé au cours de la vie est inférieur à 15-20 %, il n’y a pas d’indication pour ou contre la réalisation d’une IRM mammaire, les décisions sont prises au cas par cas (ACS). En revanche, un consensus d’opinion d’experts ne recommande pas une IRM de dépistage si le risque cumulé au cours de la vie est inférieur à 15 %(3).
Surveillance des femmes ayant un risque histologique personnel
• Surveillance des seins traités
Dans ce cadre, le risque relatif de récidive ou de découverte d’un autre cancer est augmenté. Tous les textes disponibles confirment l’article de synthèse de la Cochrane (2000) : la surveillance est basée sur l’examen clinique biannuel pendant 5 ans, puis annuel, et la mammographie ± l’échographie annuelle sans limitation de durée. Aucune autre modalité de surveillance n’a actuellement fait la preuve d’un bénéfice à la différence des patientes porteuses d’une mutation BRCA1/2 et traitées pour un cancer du sein localisé non métastatique.
L’histoire naturelle des cancers du sein démontre qu’après les pics de récidive à 2 ans et à 5 ans, des « événements » continuent d’apparaître de façon régulière au rythme de 1-2 % par an, de façon cumulative et sans limite de durée. Le risque de cancer du sein controlatéral est 2,5 fois plus élevé que dans la population générale.
– Les recommandations préconisent une surveillance mammographique annuelle sans limitation de durée(5). Après un traitement conservateur, une mammographie est effectuée 6 mois après la fin de la radiothérapie pour disposer d’un examen de référence postthérapeutique (figure 3).
Figure 3 : 64 ans : antécédent de traitement conservateur du sein droit (2006). Nodule au niveau de la cicatrice. a : Cliché post-thérapeutique (6 mois après la fin de la radiothérapie) : image claire bien limitée (en regard du nodule palpé) : cytostéatonécrose – ACR2 (constatations bénignes). b : Image claire avec des calcifications périphériques : cytostéatonécrose calcifiée – ACR2. c : Nodule « dur » : Image claire avec des calcifications périphériques en regard : cytostéatonécrose dont les calcifications se complètent – ACR2.
Deux clichés par sein sont réalisés. La mammographie analogique et la mammographie numérique ont une efficacité comparable(4). Nonobstant, dans les sous-groupes de femmes de moins de 50 ans, en périménopause ou préménopause ou ayant des seins denses (types 3 et 4 de densité selon le BI-RADS), la mammographie numérique est plus efficace. L’avantage de la mammographie numérique est incontestable pour la transmission des images et leur stockage (PACS). Il est important de disposer de l’ensemble du dossier et notamment des clichés avant et juste après l’intervention.
– L’association à une échographie est effectuée lors d’une difficulté d’analyse ou dans les seins denses. Elle permet l’étude des aires ganglionnaires axillaires et de la paroi thoracique. Une étude réalisée chez 2 725 femmes à risque élevé (dont 1 443 ont eu un cancer du sein) montre que l’échographie augmente la sensibilité de détection des cancers, mais majore le risque de faux positif(6). Les cancers détectés à l’échographie dans cette cohorte sont des cancers infiltrants de petite taille et sans atteinte ganglionnaire.
Il n’y a pas de preuve dans la littérature pour recommander une IRM de surveillance de manière systématique. Cet examen est proposé aux patientes lorsqu’il existe un doute diagnostique (cicatrice versus récidive). L’IRM a une sensibilité qui est supérieure à 90 %. La spécificité de l’IRM est aussi élevée et supérieure à 90 %. Si la lésion n’est pas accessible ou non vue en échographie, le prélèvement sera guidé sous IRM. Dans le cadre des CCIS opérés, la sensibilité de l’IRM est très inférieure (les récidives se faisant dans deux tiers des cas sous la même forme).
Des sous-groupes de femmes doivent bénéficier de cet examen lorsqu’il existe des risques génétiques associés : mutation BRCA1/2, patiente non testée apparentée au 1er degré avec une mutation BRCA, risque cumulé au cours de la vie supérieur à 20-25 %. Ces indications correspondent aux recommandations formulées par l’ACS(3). Les autres indications de réalisation d’IRM mammaire sont à discuter au « cas par cas » lors de réunions de concertation pluridisciplinaire (RCP) : lorsque le cancer initial est non détecté par la mammographie, chez les femmes jeunes (moins de 35/40 ans), dans les seins denses, patiente triple négatif. L’impact sur la mortalité n’est pas encore connu.
• Surveillance du lambeau après reconstruction mammaire
Une revue de la littérature démontre que les arguments sont faibles pour proposer une mammographie systématique du lambeau. Aucune recommandation n’est proposée.
• Surveillance de la prothèse après mastectomie reconstruction
S’il existe une suspicion de rupture, cette surveillance est comparable à l’exploration réalisée lors de la mise en place de prothèse à visée esthétique (profil costal numérisé, échographie, IRM). Notons l’importance de l’examen clinique : prothèse et recherche de récidive ou de nodule de perméation.
• Surveillance après diagnostic histologique d’hyperplasie épithéliale atypique (HEA), carcinome lobulaire in situ (CLIS)
Le risque étant accru, la surveillance mammographique est identique à celles des seins traités. La mammographie sera annuelle sans limitation de durée. L’échographie mammaire est effectuée selon les mêmes modalités.
Surveillance des seins denses
La densité mammaire est un facteur significatif et indépendant de cancer du sein, généralisable à différentes populations. La forte densité invite à envisager l’intégration de ce paramètre dans les facteurs prédictifs de cancer du sein. Au vu des données publiées, la mammographie numérique doit être privilégiée dans les seins denses chez les femmes de moins de 50 ans. Les seins denses sont responsables d’un taux de cancers de l’intervalle plus important que les seins graisseux. Entre 40 et 49 ans, une mammographie annuelle ou tous les 18 mois est recommandée. Le suivi sera ensuite biennal, dans le cadre du dépistage organisé (DO). La réalisation d’une échographie se justifie ; cet examen doit être complet et rigoureux, avec des critères diagnostiques stricts de malignité afin d’éviter un taux de suivi élevé ou des gestes interventionnels pour les lésions bénignes (faux positifs).
Actuellement, aucune étude de phase III n’a évalué l’intérêt de l’IRM dans le cadre du dépistage dans les seins denses. Si l’IRM est un examen très sensible, son impact reste inconnu dans ce contexte. La problématique reste l’évaluation de la densité des seins qui est difficilement reproductible. L’appréciation est qualitative en routine, mais il n’y a pas de méthodes standardisées de quantification. De ce fait, cette donnée n’est pas prise en compte dans les modèles prédictifs de risque de cancers du sein.
Surveillance des femmes avec un traitement hormonal de la ménopause (THM)
Il n’y a pas lieu de proposer une surveillance en imagerie particulière, la mammographie est biennale, dans le cadre du dépistage organisé des cancers du sein entre 50 et 74 ans. Si les seins sont denses, nodulaires, d’analyse difficile, une échographie complètera ce bilan.
Surveillance des femmes ayant eu une irradiation thoracique
La radiothérapie thoracique augmente le risque de cancer du sein, notamment lorsque l’irradiation est effectuée avant 30 ans. La surveillance mammographique est annuelle et complétée par une échographie. Bien qu’il y ait peu d’études publiées sur les performances de l’IRM dans cette indication, l’ACS recommande une IRM annuelle chez les patientes ayant eu une irradiation thoracique entre 10 et 30 ans(3).
En pratique
• Pour les femmes ayant des antécédents familiaux de cancers du sein ou de l’ovaire
Il est nécessaire d’évaluer le risque : une consultation d’oncogénétique est appropriée dans les cas fixés par l’expertise collective INSERM-FNCLCC (tableau ci-dessus).
L’examen clinique est semestriel.
– Dans le cadre des hauts risques : une IRM mammaire est réalisée suivie d’une mammographie, associée à une échographie mammaire. Ces examens sont effectués à partir de 30 ans.
– Dans le cadre des risques modérés : le suivi est comparable, excepté l’IRM qui n’est pas indiquée si le risque est < 15-20 %. Les femmes ayant eu une irradiation thoracique avant 30 ans (maladie de Hodgkin) sont considérées comme ayant un risque comparable aux femmes mutées BRCA1. Le suivi sera donc identique.
• Pour les femmes ayant des antécédents personnels de cancers ou de lésions histologiques à risque
L’examen clinique est semestriel pendant 5 ans (ATCD de cancer du sein) puis annuel. Une mammographie ± une échographie annuelle sans limitation de durée sont recommandées. L’IRM a des indications particulières et doit se discuter en RCP. Il n’y a pas d’indication à la réalisation d’une mammographie du sein reconstruit par lambeau.
• Pour les femmes ayant des seins denses
Entre 40 et 49 ans, le rythme de surveillance plus serré est recommandé (12 ou 18 mois). Après 50 ans, les femmes ont une mammographie tous les 2 ans, dans le cadre du dépistage organisé (DO) des cancers du sein. L’échographie mammaire est toujours réalisée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :