Imagerie obstétricale
Thérapeutique
Publié le 15 mai 2019Lecture 13 min
A.E. MILLISCHER, P. SONIGO, D. GREVENT, G. CHALOUI, B. DELOISON, M. ALISON, N. SIAUVE, L.J. SALOMON
Le placenta est un organe complexe et essentiel au développement et à la croissance fœtale. Il intervient dans les échanges fœto-maternels dès la cinquième semaine d’aménorrhée. Le placenta humain est dit de type hémochorial, c’est-à-dire que les villosités choriales sont en contact avec le sang maternel, contrairement au placenta de type epithéliochorial (comme chez les ruminants), ou encore le placenta endothéliochorial. Une perfusion et une perméabilité adéquates du placent sont essentiels.
L’insuffisance placentaire, mais aussi les anomalies d’invasion placentaire, sont des problèmes majeurs de santé publique avec de fortes morbidité et mortalité fœtales et maternelles. L’insuffisance placentaire est en effet la première cause, avec la prématurité, de morbidité et de mortalité fœtale/néonatale, et le placenta accreta, voire percreta, comporte, lui, une forte morbidité maternelle avec une prise en charge complexe.
L’exploration du placenta en imagerie repose actuellement sur l’échographie, dont les objectifs sont de définir sa localisation ou de détecter des anomalies d’implantation (placenta praevia, placenta accreta). Un des axes majeurs de la recherche pour mieux appréhender les anomalies du placenta in vivo est l’imagerie, et en particulier l’IRM, qui permet d’évaluer la fonction et l’invasion du placenta. Plusieurs études ont confirmé l'innocuité de l'IRM chez les femmes enceintes. Les séquences utilisées sont réalisées afin de diminuer au maximum le débit d’absorption spécifique (DAS), avec des champs de vue adaptés.
Le placenta normal présente un signal intermédiaire en T2, plus en hyposignal que le myomètre. Des séquences en diffusion (DAS : 0,1 watts/kg) peuvent être utilisées. Enfin, la vascularisation placentaire demeure un centre d’intérêt majeur, encore mal connu. En raison du principe de précaution, l’injection de gadolinium reste encore confidentielle du fait du manque de données chez le fœtus humain. Cependant, de récentes études ont suggéré un intérêt certain des séquences injectées pour augmenter le contraste entre placenta et myomètre, utiles pour l’analyse des anomalies d’insertion placentaire. En pratique, l’injection de gadolinium peut donc être utile dans certaines situations, mais devra se faire au plus près de la date de délivrance, en accord avec l’équipe obstétricale, pour éviter la stagnation prolongée du produit de contraste dans le liquide amniotique (figure 1).
Figure 1 : Exemple d’IRM de placenta en séquence HASTE T2 : le placenta est plus en hyposignal que le myomètre. On suit parfaitement le liseré rétroplacentaire sous forme d’un fin liseré en hyposignal T2.
Insuffisance placentaire
Elle correspond à un dysfonctionnement placentaire, qui est le plus souvent lié à un défaut de perfusion aboutissant à une diminution de l’apport en oxygène et en nutriments au fœtus. Elle est responsable de pathologies materno-fœtales fréquentes, potentiellement sévères, dont les 2 principales sont la prééclampsie et le retard de croissance intra-utérin (RCIU).
Plusieurs techniques IRM permettent aujourd’hui d’appréhender in vivo le fonctionnement du placenta.
• L’IRM avec injection de produit de contraste (DCE-IRM).
C’est la technique historique pour mesurer la perfusion d’un organe. L’acquisition d’image va se faire avant, pendant et après l’injection d’un produit de contraste. La cinétique de rehaussement de l’organe d’intérêt va être analysée en comparaison avec le rehaussement obtenu dans le secteur vasculaire artériel (cavité cardiaques et/ou gros vaisseaux).
Les paramètres fonctionnels sont obtenus à partir de la modélisation pharmacocinétique de la distribution de l'agent de contraste. Selon les modèles utilisés, plusieurs paramètres fonctionnels peuvent être obtenus : le débit sanguin, la perfusion, la fraction volumique de sang, le coefficient de perméabilité surfacique... Ces paramètres peuvent également être utilisés pour générer des images codées en couleur qui aident à l'évaluation visuelle des tissus (carte paramétrique).
Seules des études animales sont disponibles dans la littérature. Notre équipe a développé plusieurs approches pour étudier le placenta chez la souris ou le rat en utilisant un agent de contraste. Nous avons principalement utilisé un chélate de Gd disponible dans le commerce (Dotarem®), qui traverse la barrière materno-fœtale dans le placenta.
La DCE-IRM reste probablement, à ce jour, le moyen le plus robuste pour évaluer la fonction placentaire in vivo. Elle permet la quantification directe du flux sanguin et repose sur une méthodologie bien standardisée qui a été décrite de manière exhaustive. En revanche, l’utilisation de produit de contraste chez la femme enceinte reste très discutée et ces techniques ne peuvent être pour l’instant transposées en clinique (figures 2a et b).
Figure 2a : Exemple de séquence dynamique après injection de gadolinium chez la souris. Sur cette image coronale, on visualise quatre placentas présentant un rehaussement après injection (flèches). Le ventricule gauche se rehausse de façon précoce et intense, avec un pic, ce qui correspond au premier passage. Le rehaussement observé dans les placentas est moins intense et plus progressif. À noter qu’il n’y a pas de rehaussement fœtal.
Figure 2b : Exemple de séquence dynamique après injection de gadolinium chez la souris. Exemple de courbes en intensité de signal (IS) pour le ventricule gauche (VG) et trois placentas et fœtus après injection de gadolinium. Le ventricule gauche se rehausse de façon précoce et intense, avec un pic, ce qui correspond au premier passage. Le rehaussement observé dans les placentas est moins intense et plus progressif. À noter qu’il n’y a pas de rehaussement fœtal.
Afin d’évaluer l'utilisation de l'imagerie par résonance magnétique DCE pendant la grossesse, les données concernant le transfert placentaire et les plages normales de perfusion placentaire devraient maintenant être établies. Un protocole de recherche, PLACENTIMAGE, visant à évaluer la faisabilité de la DCE IRM chez les femmes enceintes et à construire des normes de référence pour la perfusion placentaire vient d’être achevé (figure 3).
Figure 3 : Exemple de séquence dynamique après injection de gadolinium chez l’Homme. Sur cette image axiale, une région d’intérêt est positionnée sur le placenta (jaune) et sur l’aorte (rouge).
• BOLD IRM
Cette technique utilise l'hémoglobine (Hb) en tant que « agent de contraste endogène » pour visualiser une fonction plutôt qu'une structure. La désoxyhémoglobine (dHb) a des propriétés paramagnétiques et induit une diminution de T2 et T2*. À l’inverse, l’oxyhémoglobine a des propriétés diamagnétiques. L'effet BOLD mesure donc la différence de signal et ou de T2* entre deux états différents d’oxygénation : une référence (état normal ou de repos) et une hypo/hyper-oxygenation status (ou état actif).
Les variations de la saturation en oxygène de l’hémoglobine dans les capillaires peuvent être détectées par l'intermédiaire des modifications de SI ou par la modification du T2 ou T2* qu’ils induisent.
Les premières publications basées sur l'IRM BOLD pendant la grossesse étaient expérimentales sur des modèles animaux. L’IRM BOLD est également capable de détecter un une anomalie du fonctionnement placentaire dans les contextes de retard de croissance intra-utérin. En effet, plusieurs études chez l’animal, mais également chez l’Homme, ont montré que les placentas n’affichent pas le même effet BOLD en situation de RCIU. Cette technique pourrait donc permettre de repérer précocement des placentas dysfonctionnels.
L’IRM BOLD pourrait également être utilisée pour l’imagerie fonctionnelle du cerveau du fœtus. Certaines difficultés techniques doivent cependant être surmontées. Un essai de recherche clinique en IRM BOLD chez les femmes enceintes comme outil de diagnostic non invasif de l’insuffisance placentaire est actuellement en cours.
• Arterial Spin Labelling (ASL) IRM
L’ASL IRM est une autre technique d' IRM qui peut être utilisée pour évaluer la perfusion placentaire. Aucune injection intraveineuse de produit de contraste n'est nécessaire. L'IRM ASL utilise l'aimantation du sang artériel entrant dans l'organe d'intérêt. L'eau dans le sang artériel est utilisée comme traceur endogène. Cette eau est marquée dans une région d'intérêt par une impulsion de radiofréquence sélective (RF) qui inverse le signal des protons du sang. Deux séquences d'acquisitions sont nécessaires.
La soustraction d'images marquées et non marquées « par paires » donne une différence de signal qui reflète la perfusion tissulaire, étant donné que la différence de signal est liée aux protons artériels marqués en mouvement (figure 4a et b).
Figure 4a : Principe de l’ASL illustré chez la rate gestante : l'image anatomique de référence est une image coronale de rate enceinte dans laquelle sont visualisées les unités fœto-placentaires. La figure illustre la production de l'image taguée. Dans l'image la plus à gauche, le tag est effectué par inversion magnétique en dehors de la zone d'étude (boîte verte) et conduit à des spins marqués dans le sang artériel (points rouges). Un délai avant l'acquisition est nécessaire pour la progression des spins marqués vers la région d’intérêt : le temps de transit (image du milieu). Ensuite, l'acquisition est effectuée au niveau d'intérêt (jaune) contenant les spins marqués (image de droite).
Figure 4b : Principe de l’ASL illustré chez la rate gestante : l'image anatomique de référence est une image coronale de rate enceinte dans laquelle sont visualisées les unités fœto-placentaires. Les images appelées « marquées » et « témoins » sont ensuite « soustraites » pour ne conserver que le signal des protons mobiles contribuant à la perfusion tissulaire. Le signal résiduel reflète donc la perfusion, ici le flux sanguin placentaire (PBF).
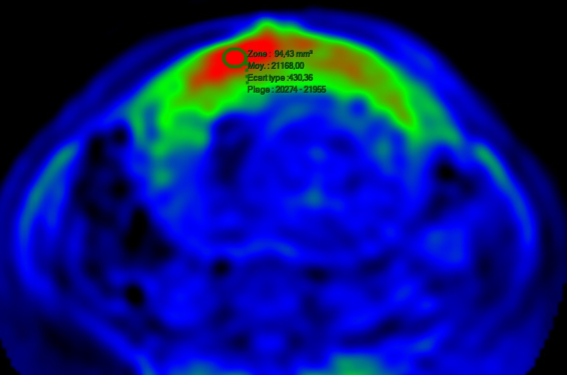
Quelques études ont été réalisées chez l’animal et la technique très prometteuse commence à être expérimentée chez le placenta humain. Les applications actuelles de l'ASL chez l’homme concernent principalement la perfusion cérébrale (figure 5).
Figure 5 : Exemple de cartographie de flux placentaire obtenue par ASL chez l’humain.
• Intra Voxel Incoherent Motion (IVIM) et IRM de diffusion
L’imagerie de diffusion fournit un contraste par la mesure du déplacement des molécules d'eau dans les tissus, qui diminue le signal.
Le concept IVIM (Intra Voxel Incoherent Motion) est basé sur l'hypothèse que le signal pondéré en diffusion dans un voxel dépend de deux compartiments. Le premier compartiment est composé de molécules d'eau extravasculaires (mouvement brownien thermique), dont le déplacement correspond à la diffusion. Le deuxième compartiment est composé de molécules d'eau intravasculaire circulant dans le réseau capillaire, dont le déplacement correspond à une perfusion (ou pseudo-diffusion). Les coefficients de diffusion apparents (ADC) et les paramètres IVIM sont obtenus à partir de la courbe de décroissance du signal à des b différents.
Les paramètres de IVIM sont calculés à partir d’une décroissance bi-exponentielle de la courbe d'intensité de signal en fonction des valeurs de b. Trois paramètres sont obtenus : le coefficient de diffusion (D, 10-3 mm2/s) qui traduit la diffusion tissulaire alors que les deux autres — la fraction de perfusion (f, %) et le coefficient de pseudo-diffusion (D*, 10-3 mm2/ s) — sont liés à la microcirculation. Pour l’imagerie du placenta, f est susceptible de représenter la fraction de volume de sang en mouvement par rapport au volume total de voxels. D* refléterait la circulation du sang dans les espaces intervilleux et dans les capillaires à l'intérieur des villosités fœtales. D reflète les caractéristiques cellulaires et interstitielles du tissu.
Plusieurs études ont établi les valeurs des principaux paramètres chez l’animal. Chez l’humain, plusieurs études ont également suggéré que les paramètres d’IVIM et de diffusion placentaire seraient perturbés en cas de retard de croissance intra-utérin.
Mesurer ADC peut être utile pour détecter des changements structurels dans le placenta IUGR. Analyser IVIM avec une mesure plus précise de la fraction de perfusion f peut se révéler intéressant pour le diagnostic de l’insuffisance placentaire dans IUGR et la prééclampsie, une technique non de contraste pour l’évaluation de la perfusion.
Anomalies d’insertion placentaire
• Placenta praevia
Ceci correspond à une insertion basse du placenta sur le segment inférieur de l’utérus à moins de 2 cm de l’orifice interne. Il peut être partiellement ou complètement recouvrant sur le col. Une localisation placentaire basse est fréquente en début de grossesse (25 %) avant 20 SA. Compte tenu du développement du segment inférieur, le pourcentage est réduit à 1 % au 2e et 3e trimestres. Sa prévalence augmente avec l’âge maternel et avec le nombre de césariennes.
L’échographie abdominale est habituellement suffisante pour le diagnostic de placenta praevia avec une sensibilité de 93-97 %. L’IRM présente peu de valeur ajoutée pour ce diagnostic, à l’exception de la localisation placentaire postérieure (figure 6).
Figure 6 : Exemple de placenta praevia (P) en séquence sagitale HASTE T2 ; notons que le myomètre (M) est particulièrement fin, au niveau du segment inférieur.
• Placenta accreta (abnormal invasive placenta)
Le placenta accreta est défini cliniquement par une adhérence anormale du placenta à la paroi utérine générant une absence de clivage au décours de la délivrance. Cette pathologie est secondaire à une invasion anormale des villosités choriales au sein du myomètre. On distingue trois types de « placenta accreta » selon la profondeur d’envahissement myométrial (i.e. accreta, increta, percreta). Le placenta accreta est le type plus fréquent (60-78 %), avec des villosités pénétrant de façon superficielle au sein du myomètre sans extension en profondeur. Dans le placenta increta (20 %), les villosités envahissent toute l’épaisseur du myomètre sans franchir la séreuse. Le placenta percreta (5-20 %) représente la forme la plus sévère, où le tissu placentaire envahit tout le myomètre avec une extension au-delà de la séreuse et une possibilité d’extension aux organes adjacents.
L’IRM est actuellement réalisée de façon quasi systématique lorsqu’il existe une suspicion clinique et échographique de placenta accreta.
Plusieurs critères diagnostiques IRM en pondération T2 ont été proposés pour suggérer le diagnostic : aspect hétérogène ou « bombant » du placenta sur la séreuse utérine, bandes sombres en « hyposignal T2 » perpendiculaires à l’interface myomètre-placenta, interruption du liseré rétroplacentaire avec présence de placenta exophytique au sein du myomètre, extension tissulaire placentaire au-delà de la séreuse utérine aux organes adjacents. Malgré l’absence de consensus sur l’utilisation du gadolinium en cours de grossesse, son intérêt potentiel des séquences injectées par rapport aux séquences T2, pour un meilleur contraste tissulaire entre myomètre et placenta après 30 SA, peut s’avérer intéressant. La toxicité du gadolinium restant inconnue sur le fœtus, la société européenne de radiologie réserve son utilisation aux cas où le bénéfice diagnostique est largement plus important que les risques pour la mère (figures 7a, b et figure 8).
Figure 7a : Exemple de placenta suspect d’accreta sur la séquence classique HASTE T2.
Figure 7b : Exemple de placenta suspect d’accreta sur la séquence classique HASTE T2 infirmée par la séquence sagittale T1 avec injection de gadolinium où l’on distingue bien l’interface placenta-myomètre.
Figure 8 : Exemple de placenta percreta en séquence sagittale Haste T2 : le placenta est bombant, hétérogène, avec plusieurs bandes sombres perpendiculaires au liseré rétroplacentaire. On ne distingue plus de myomètre sain entre la vessie et le placenta, celui-ci envahissant la séreuse vésicale.
• Anomalies de l’insertion placentaire du cordon : vasa praevia
Le dépistage des vasa praevias est capital car particulièrement dangereux, en raison du risque de procidence ou d’hémorragie de Benckiser lors de la rupture d’un vaisseau praevia à l’ouverture des membranes. Ce sont les insertions marginales basses ou vélamenteuses (1/500), Cette anomalie résulte souvent d’une résorption placentaire asymétrique sur un placenta initialement inséré bas. Elle est avant tout dépistée en échographie, mais l’IRM peut s’avérer utile pour confirmer l’insertion vélamenteuse et la topographie exacte du placenta.
Au final
L’IRM s’avère donc complémentaire à l’échographie et bien adaptée pour le diagnostic des anomalies d’insertion placentaire, notamment dans l’évaluation de la profondeur d’invasions type percreta. Par ailleurs, l’identification précoce des fœtus à risque élevé de RCIU est un des défis en obstétrique moderne. L’IRM fonctionnelle du placenta représente une perspective intéressante en imagerie pour le suivi des grossesses à haut risque. Cependant, malgré la disponibilité de nombreuses techniques d'IRM pour étudier le fonctionnement du placenta, les études in vivo du placenta humain sont encore rares. L’intérêt respectif de chaque méthode devrait être rapidement appréhendé et une standardisation des techniques apparaît nécessaire afin de permettre à l’IRM obstétricale de trouver la place qu’elle mérite !
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :