Imagerie obstétricale
De l’image à la clinique
Publié le 06 mar 2023Lecture 6 min
MALADIES TROPHOBLASIQUES GESTATIONNELLES : QUELLE PLACE POUR LA CHIRURGIE ?
Antoine SCATTARELLI(a), M. PERRIN(a), C. HENNETIER(a), A. AGOSTINI(b), P. CROCHET(a) - a. Service de gynécologie-obstétrique, CHU de Rouen ; b. Service de gynécologie-obstétrique, Hôpital de la Conception, Marseille
Les maladies trophoblastiques gestationnelles comprennent un ensemble hétérogène de pathologies dues à une prolifération anormale du trophoblaste. Il s’agit de pathologies rares et le plus souvent de bon pronostic. Les recommandations de prise en charge reposent surtout sur des avis d’expert, comme celles publiées en 2020 par le groupe européen EOTTD (European Organisation for the Treatment of Trophoblastic Disease)(1). La chirurgie est la base du diagnostic et du traitement pour les môles hydatiformes. Pour les tumeurs trophoblastiques gestationnelles, le traitement médical par mono ou polychimiothérapie sera utilisé en première intention. L’hystérectomie est une option possible en cas de maladie limitée à l’utérus. La chirurgie sera le plus souvent associée à la chimiothérapie dans les très rares cas de tumeurs du site d’implantation.
Les maladies trophoblastiques gestionnelles constituent un ensemble hétérogène de pathologies caractérisées par une prolifération anormale de tissu trophoblastique. Elles regroupent les môles hydatiformes partielles ou totales et les tumeurs trophoblastiques gestationnelles comprenant les môles invasives, choriocarcinomes, tumeurs du site d’implantation et les tumeurs trophoblastiques épithélioides. En France, il est recommandé de déclarer les cas de tumeur trophoblastique gestationnelle au centre de référence de Lyon.
Môles hydratiformes
Diagnostic
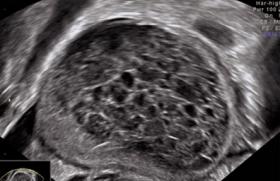
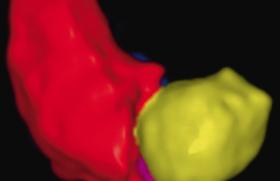
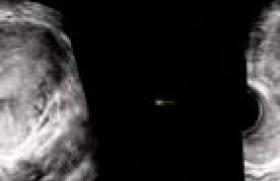
Le diagnostic de môle hydatiforme est suspecté le plus souvent devant des métrorragies du 1er trimestre, une échographie Doppler d’aspect inhabituel (figures 1 et 2) et un dosage des HCG plasmatiques anormalement élevé. Le diagnostic de certitude sera anatomo-pathologique (produit d’aspiration endo-utérine).
Figure 1. Prise en charge des tumeurs trophoblastiques gestationnelles selon
le stade FIGO 2000 (hors tumeurs du site d’implantation et tumeurs épithélioïdes).
Figure 2. Prise en charge des tumeurs trophoblastiques du site d'implantation selon le stade de la maladie.
Prise en charge thérapeutique
Dès que le diagnostic est suspecté, il est recommandé de réaliser un traitement par aspiration endo-utérine sous contrôle échographique, qui sera suffisant dans la majorité des cas (et répété une seule fois en cas de résidu > 17 mm d’épaisseur à J15). En cas de projet parental abouti, une hystérectomie totale inter-ovarienne peut être proposée en alternative à l’aspiration endo-utérine.
Surveillance
Après la prise en charge d’une môle hydatiforme, une surveillance hebdomadaire des hCG (hormones chorioniques gonadotropes) est nécessaire dans tous les cas. Après négativation, deux dosages négatifs sont nécessaires après une môle partielle. Après une môle complète, la surveillance sera poursuivie mensuellement pendant 6 mois. Elle peut être étendue à 30 mois supplémentaires chez les patientes ayant une môle complète ou sur grossesse gémellaire chez des patientes de moins de 45 ans ou lorsque le délai de normalisation des hCG est ≥ 8 semaines.
Le risque de transformation maligne des grossesses molaires après normalisation du taux d’hCG est de 0,4 %. Ce risque est nul en cas de môle partielle et peut être augmenté en cas de môle complète ou sur grossesse gémellaire chez les patientes âgées au moins de 45 ans et lorsque le délai de normalisation des hCG est ≥ 8 semaines(2) (figures 3 et 4).
La stagnation (± 10 %) du taux d’hCG sur 4 valeurs consécutives ou l’augmentation sur 3 valeurs (> 10 %) définit le passage à une forme cancéreuse (tumeurs trophoblastiques gestationnelles).
Figure 3. Échographie d’une môle partielle.
Figure 4. Échographie d’une môle complète.
Tumeurs trophoblastiques gestationnelles
Bilan d’extension
En cas de diagnostic histologique d’une tumeur trophoblastique gestationnelle, il est nécessaire de compléter le bilan par une nouvelle échographie pelvienne et une radiographie du thorax à la recherche de lésions secondaires pulmonaires. Si celles-ci sont suspectées, un complément d’exploration par IRM cérébrale et abdomino-pelvienne avec injection de produit de contraste est recommandé. Ces différentes explorations permettent la réalisation du calcul du score FIGO 2000 permettant d’orienter la prise en charge vers une mono ou une polychimiothérapie (tableau 1).
Prise en charge thérapeutique
Toute prise en charge d’une tumeur gestationnelle trophoblastique doit être discutée dans le centre de référence. Le niveau de risque est évalué selon le score FIGO 2000 (figure 1). Pour les patientes traitées pour une môle invasive ou un choriocarcinome, le taux de morta-lité à 5 ans est estimé à 0,3 % pour les bas risques, et à 12 % pour les hauts et très hauts risques(3).
• Tumeur trophoblastique gestationnelle à faible risque (score FIGO ≤ 6)
Il est recommandé la réalisation d’une monochimiothérapie par méthotrexate. En cas de tumeur trophoblastique gestationnelle limitée à l’utérus (stade I) chez une patiente ayant abouti son projet parental, l’hystérectomie totale inter-ovarienne est une option et peut être une alternative à la chimiothérapie (taux de guérison de 82,4 %)(4). La chimiothérapie doit tout de même être préférée dans les stades I en cas de score FIGO 5 ou 6, de diagnostic de choriocarcinome connu avant la prise en charge ou chez les patientes jeunes.
Après normalisation du taux d’hCG, une imagerie des sites métastatiques peut être réalisée pour référence. Seul le taux d’hCG doit être utilisé comme marqueur de l’activité de la maladie. Une contraception est recommandée jusqu’à 1 an après la fin de la chimiothérapie. En cas de grossesse ultérieure, le taux d’hCG doit être dosé 6 semaines après le postpartum et le placenta envoyé en analyse anatomopathologique.
• Tumeur trophoblastique gestationnelle à haut risque (score FIGO : 7 à 12) et très haut risque (score FIGO >12)
En cas de haut risque, il est recommandé la réalisation d’une polychimiothérapie par étoposide, méthotrexate, actinomycine et cyclophosphamide (EMA-CO). Après normalisation du taux d’hCG, les patientes reçoivent une cure de consolidation entre 4 et 8 semaines, selon les recommandations du centre référent. En cas de très haut risque, il est recommandé de réaliser une prise en charge par polychimiothérapie dans un centre de référence. Il n’existe pas d’indication chirurgicale pour les tumeurs à haut et très haut risque.
La décroissance des hCG est surveillée de façon hebdomadaire 6 semaines après la normalisation du taux, puis 1 fois par mois pendant 12 mois. Une imagerie corps entier après traitement peut être réalisée pour référence. Le suivi minimum doit être de 5 ans. Une contraception est recommandée jusqu’à 1 an après la fin de la chimiothérapie.
• Tumeurs du site d’implantation et tumeurs gestationnelles trophoblastiques épithélioïdes
Ces tumeurs sont très rares (62 cas recensés par le centre lyonnais pendant la période 1999- 2018). Le diagnostic histologique doit être confirmé par un pathologiste référent. Le bilan d’extension doit contenir une IRM cérébrale et pelvienne ainsi qu’un scanner thoraco-abdominal. La prise en charge est guidée par le stade et l’intervalle de temps entre la dernière grossesse et le début de prise en charge (tableau 2 et figure 2).
La chirurgie prend une place majeure dans la prise en charge de ces tumeurs moins sensibles à la chimiothérapie(1). La recherche de marges d’exérèse est essentielle lors de la prise en charge chirurgicale.
En cas de stade I avec un intervalle inférieur à 48 mois, une hystérectomie seule est recommandée. S’il existe un de désir de grossesse, une préservation de la fertilité peut être discutée. Si l’intervalle est ≥ 48 mois, une chimiothérapie adjuvante à base de sels de platine doit être effectuée après l’hystérectomie.
En cas de stade II ou III avec un intervalle inférieur à 48 mois, la prise en charge comprend une hystérectomie suivie d’une chimiothérapie à base de sels de platine. Les curages sont à réaliser en cas de suspicion d’atteinte ganglionnaire. Il est conseillé de réaliser une résection chirurgicale de tout résidu tumoral visible après la chimiothérapie adjuvante.
En cas de stade II ou III avec intervalle ≥ 48 mois ou stade IV, il est recommandé de réaliser une prise en charge chirurgicale de toute lésion visible, associée à une chimiothérapie haute dose ou à du pembrolizumab.
Il n’existe pas de consensus sur la surveillance après prise en charge. Lorsque le taux d’hCG est initialement faible, la surveillance sera réalisée par imagerie selon l’avis du centre de référence. Si le taux d’hCG est initialement élevé, la surveillance se fera par bilan biologique hebdomadaire pendant 6 semaines après normalisation, mensuel pendant 1 an et prolongée jusqu’à 10 ans.
EN PRATIQUE
L’aspiration endo-utérine sous contrôle échographique est le gold standard pour la prise en charge des môles hydatiformes.
L’hystérectomie totale inter-ovarienne est une option en cas de môle hydatiforme chez les patientes ayant accompli leur projet parental.
En cas de tumeur trophoblastique gestationnelle de stade I à bas risque chez les patientes ayant abouti leur projet parental, l’hystérectomie peut être une alternative au traitement par chimiothérapie.
Une chirurgie doit être réalisée si possible pour les tumeurs du site d’implantation.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :